
제품 소개
Pegasus™ SV4 virus removal filter cartridges
유속 관련 성능이 안정적인 필터
대폭 감소된 비용으로 탁월한 바이러스 제거 (Viral clearance) 기능 제공
모든 바이오의약품은 언제나 바이러스 오염을 경계해야 합니다. 바이러스 오염의 원인및 경로로는 배양 배지로부터 또는 생산 공정 중에 세포주나 제품에 유입되는 외부 유래 바이러스, 또는 세포주와 관련된 내생 바이러스가 있습니다. 기증된 혈장 유래 물질에도 바이러스가 존재할 수 있습니다.
Pegasus™ SV4 Virus 제거 카트리지 필터는 파보 바이러스와 대형 바이러스를 안정이고 효과적으로 제거합니다. 또한, 희석 및 복합/농축 생물학적 유체에서 연속적이고 안정적인 유속과 높은 처리량을 가집니다. 이러한 장점을 바탕으로 매우 높은 효율의 공정 수행이 가능합니다.
규격사양
사용 조건*
증기 멸균 시 0.3bard(4.3psid)
완전성 검사 한정 6.2bard(90psid)
LRV 4 초과 **†
포유류 파보 바이러스에서 일반적으로 예상되는 LRV 4 초과
2.25m2 (24ft2)
다른 Pegasus™ Grade SV4 Virus Filter로 공정 확장
(In-Line Style)
(T-Style)
이 표는 Pegasus™ SV4 제품 포트폴리오입니다. 일부는 판매 중이 아닐 수 있습니다. 정확한 정보는 현지 Pall 담당자에게 문의하시기 바랍니다.
*** Filterability Tool 버전 (FT). 바이러스 제거 부적격. Filterability 검사 전용
성능
파보바이러스 제거 성능 강화
Pegasus™ SV4 바이러스 제거 카트리지 필터는 작은 크기의 ‘외피가 없는’ 바이러스와 큰 바이러스의 제거 성능이 탁월합니다. 그림 1은 PDA 가이드라인에 따라 1g.L-1 BSA 용액에서 Pegasus™ SV4 필터의 일반적인 성능을 나타내며, 강력한 파보 바이러스 제거 성능을 확인할 수 있습니다.
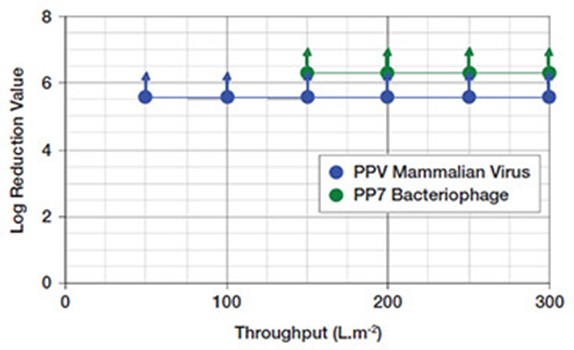
1독립적인 바이러스 검증 시험 실험실에서 PPV retention 시험 실시(47mm 필터 디스크 사용)
Flux decay 저항성과 독보적인 처리량으로 인해, 일반적인 스파이크는 Pegasus™ SV4 바이러스제거 카트리지 필터의 Flux decay에 큰 영향을 미치지 않습니다.
독보적인 처리량과 일정하고 안정적인 유속
원가 관리는 다운스트림 공정의 주요 고려 사항 중 하나입니다. Pegasus SV4 바이러스 제거 필터 멤브레인은 일정하고 안정적인 유속과 독보적인 처리량을 제공하며, 원가 절감도 가능합니다. 이로써, 공정 및 비용 관리를 개선하고 바이러스 여과의 경제성과 효율성을 극대화할 수 있습니다.
높은 효율성 및 경제성
또한 Pegasus™ SV4 바이러스 제거 필터 멤브레인은 작은 크기의 ‘외피가 없는’ 바이러스와 큰 바이러스를 모두 효과적인 제거 성능을 가지며, 희석 또는 복합/농축 생물학적 유체에 사용할 때 일정하고 안정적인 유속을 확보합니다. 또한, 복합/농축 feed 시에도 안정적인 압력/flux를 제공하여, 고농축 단백질 용액의 바이러스 여과 시 경제성을 향상시킵니다. 그림 2는 단일클론 항체 용액에서 Pegasus™ SV4 바이러스 제거 카트리지 필터의 일반적인 flux 특성입니다.
최대 25g.L-1(2.5%) MAb로 2.1bar(30psi) 또는 3.1bar(45psi)에서 여과 성능 검사 결과
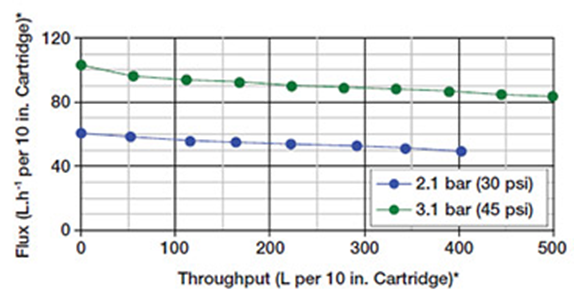
*Pegasus SV4 Virus Removal Filter Disc (47mm) 검사를 통한 성능 예측
공정 비용 절감

Pegasus™ SV4 바이러스 제거 카트리지 필터의 Laid-over pleat 구조
Pegasus™ SV4 바이러스 제거 카트리지 필터는 특허받은 Laid-over pleat 구조를 적용하여 카트리지당 필터 면적(2.25 m2)이 매우 넓기 때문에, 카트리지마다 훨씬 많은 필터 멤브레인을 사용할 수 있습니다. 이를 통해 카트리지 필터 사용량을 절감하여 공정 생산성을 극대화하는 동시에 비용을 절감하고, 바이러스 필터 시스템의 hold-up volume을 최소화합니다.
우수한 공정 제어 및 안전성
Pegasus™ SV4 바이러스 제거 카트리지 필터는 공정 규모의 바이러스 여과에서 최고 수준의 공정 제어 및 안전성을 제공합니다.
Pegasus™ SV4 바이러스 제거 카트리지 필터완전성 검사

Palltronic® Flowstar 필터 완전성 검사 기기를 활용한 Pegasus™ SV4 바이러스 제거 카트리지 필터완전성 검사

완전히 자동화된 Cytiva의 바이러스 여과 시스템
© CSL Ltd, 2010
완전히 자동화된 바이러스 여과 시스템에 적합
정확하고 일관되게 작동하는 완전 자동화 바이러스 여과 시스템으로 공정 효율을 강화합니다. Steam in place(SIP), Clean in place(CIP) 및 현장 완전성 검사(ITIP) 기능을 제공할 수 있습니다. 클러스터 여과 기술로 필터 완전성 민감도를 극대화합니다. 완전히 자동화된 Cytiva 의 바이러스 여과 시스템은 최고 수준의 제조 안전성 및 공정 성능을 보장합니다.
여러 생산 단계에서 엄격한 품질 검사
Pegasus™ SV4 바이러스 제거 카트리지 필터제조 과정에서는 엄격한 품질 관리 시스템으로 각 제품의 사양에 따른 일관된 성능을 보장합니다.
- 제조 단계 곳곳의 품질 관리
- 100% Fabrication 완전성 검사 – PP7 박테리오파지 제거 관련
- PP7 박테리오파지 로트 출하 검사와 함께 Viral reduction 검사
- 100% Fabrication water flow 검사
- Protein transmission 검사
- 육안 검사 제어

2D 바코드가 식각된 Pegasus™ SV4 Virus Removal Filter Cartridge
완벽한 추적성, 빠르고 효율적인 데이터 입력
Pegasus™ SV4 바이러스 제거 카트리지 필터는 ISO 9001:2008 인증을 통과한 품질관리 시스템에서 제조되며 제품 번호, 로트 번호 및 고유 일련 번호로 쉽게 식별할 수 있고, 카트리지 필터에 2차원(2D) 바코드가 레이저로 식각되어 있습니다 바코드를 읽어서 제조 이력을 완벽하게 추적할 수 있습니다.

Palltronic® 바코드 리더 및 Palltronic® Flowstar 필터 완전성 검사 기기로 Pegasus SV4 바이러스 제거 카트리지 필터바코드를 스캔
높은 품질 표준
필터 구성 요소는 USP <88>(Class VI – 121 °C plastics)의 체내 생물학적 반응 및 USP <87>(Elution Test)의 체외 생물학적 반응 요건을 충족합니다.
- USP <788>(Particulate Matter in Injections)의 Cleanliness 기준 충족
- CFR Part 211.72 및 210.3(b) (6) Title 21의 Non-Fiber-Releasing 기준 충족
- USP <85>(Bacterial Endotoxins Test)의 Non-Pyrogenic 기준 충족
카트리지 필터에는 최신 법률 및 지침에 따라 TSE 또는 BSE 위험 물질로 지정된 재료를 사용하지 않습니다(European CPMP EMA/410/01 및 U.S. CFR, Title 21 Part 189.5 참조).








